SITUAZIONE
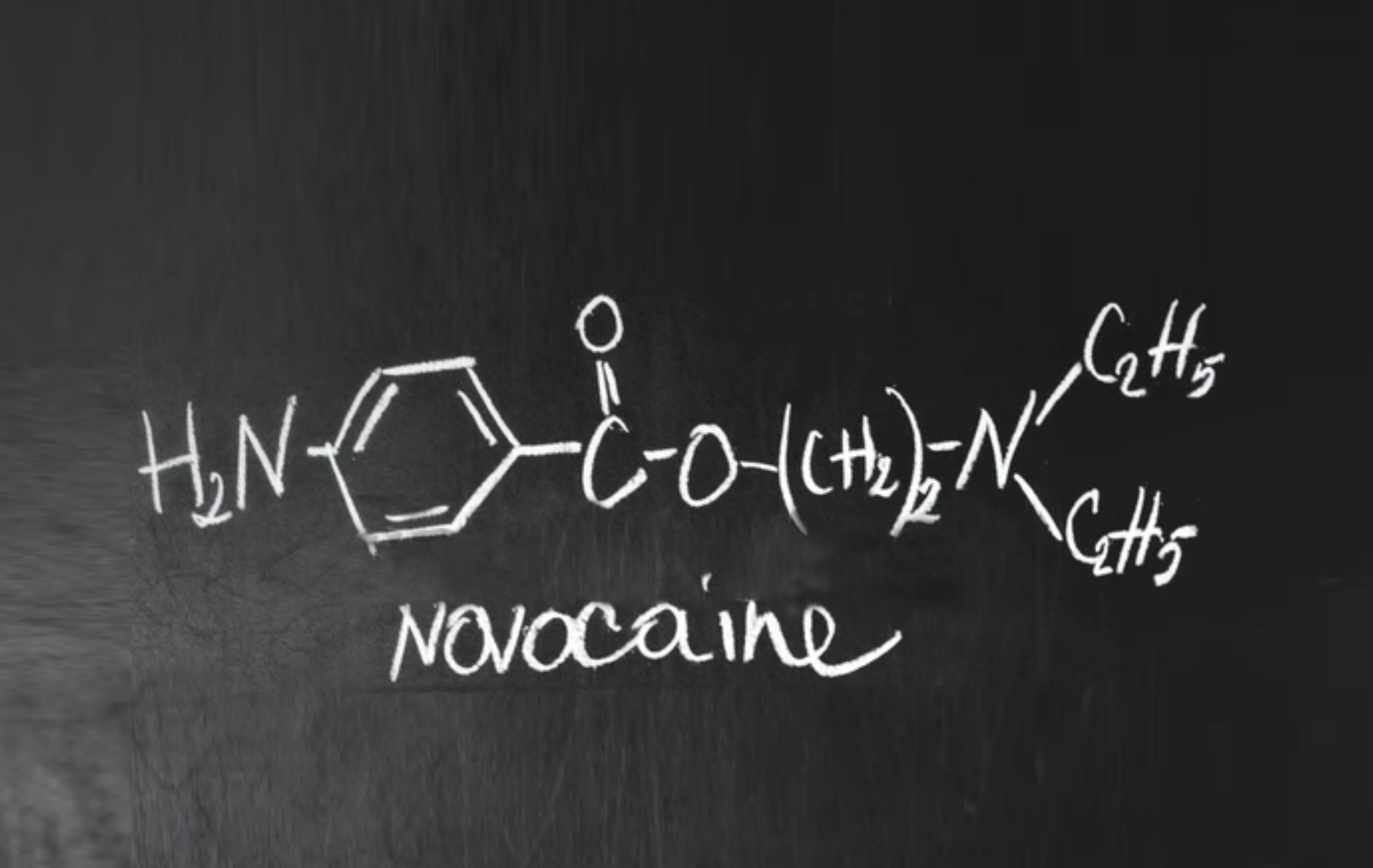
L’API – Procaina HCl viene utilizzato in numerose formulazioni farmaceutiche e dispositivi medici come anestetico locale, che trova la sua applicazione in differenti ambiti medici.
Dal 2016, l’unico produttore europeo dismette la produzione del principio attivo – Procaina HCl per destinazione d’uso umana.
Il mercato farmaceutico rischia di restare scoperto entro il 2021, poiché gli ultimi lotti prodotti di Procaina HCl garantiscono una validità (shelf life) di soli cinque anni.
Le Aziende farmaceutiche, titolari dell’immissione in commercio di tali farmaci a base di Procaina HCl, non possono più approvvigionarsi da un produttore qualificato ed autorizzato, poiché i pochi produttori mondiali esistenti non sono in conformità coi requisiti regolatori e qualitativi necessari e richiesti dall’Autorità europea dei medicinali.
Questa situazione tende alla inevitabile dismissione ed irreperibilità dei farmaci a base di Procaina HCl.
SFIDA
L’obiettivo di Flarer SA è di riuscire a strutturare e programmare la produzione dell’API – Procaina HCl in tempi ristretti, elaborando e sviluppando un supporto tecnico e documentale di alto profilo qualitativo, che venga accettato ed approvato dall’Autorità europea dei medicinali per l’uso nel mercato europeo, con il conclusivo rilascio del Certificato di Conformità alla Farmacopea Europea (CEP) da parte di EDQM.
Il tutto deve essere concluso entro i cinque anni di validità degli ultimi lotti prodotti di API – Procaina HCl dal fabbricante europeo, al fine di evitare la rottura di stock di numerosi titolari AIC europei, con il conseguente decadimento delle autorizzazioni all’immissione in commercio dei vari farmaci.
SOLUZIONE
Flarer SA ha portato a compimento una analisi di mercato strutturata, coinvolgendo alcuni propri clienti utilizzatori dell’API – Procaina HCl ed individuando anche altri titolari di AIC, determinando le formulazioni medicinali interessate e precisando i quantitativi di API potenzialmente richiesti.
È stato così condotto uno studio di valutazione dell’incidenza economica del principio attivo, sia per quei prodotti a rischio dismissione che per possibili nuove formulazioni, quantificando e definendo l’ambito di interesse del progetto.
Si è individuato il partner manifatturiero con il più idoneo e qualificato know-how ed asset produttivo, al fine di meglio supportare l’intero progetto di sviluppo e produzione sintetica della molecola – Procaina HCl.
In collaborazione col partner manifatturiero, è stato strutturato il processo di realizzazione dell’intero progetto e, considerando lo sviluppo chimico/sintetico e quello documentale necessari, è stata elaborata una previsione diacronica che permettesse di definire l’intero iter per l’ottenimento del prodotto e delle certificazioni qualitative.
Flarer SA ha coinvolto un gruppo di clienti utilizzatori finali, i quali da subito hanno dimostrato il maggiore interesse per il progetto e la più forte necessità di fornitura dell’API – Procaina HCl, generando una sinergia produttiva che permettesse il completo e fluido ottenimento del progetto.
Il processo produttivo è stato avviato, a seguito del perfezionamento della via sintetica della molecola, così da ottenere quattro lotti di validazione dell’API, sviluppando nel contempo l’intero comparto tecnico ed il supporto documentale, al fine di ottemperare ai requisiti normativi e qualitativi.
È stato così possibile ultimare l’elaborazione e la strutturazione del Eu-DMF dell’API – Procaina HCl, procedendo quindi al deposito di quest’ultimo presso l’Autorità Europea EDQM, condizione necessaria e propedeutica all’ottenimento del Certificato di Conformità alla Farmacopea Europea (CEP), rilasciato il 14/11/2022.
RISULTATI
È stato portato a termine il processo sintetico ed è stato migliorato il metodo analitico della molecola – Procaina HCl.
In soli 36 mesi dall’inizio del progetto, è stata ultimata la produzione industriale ed è avvenuto il rilascio in GMP dei quattro lotti di validazione di API.
La solida struttura e l’alto profilo qualitativo del pacchetto documentale e dell’Eu-DMF, a supporto dell’API – Procaina HCl, hanno consentito l’ottenimento del CEP entro 18 mesi dalla relativa sottomissione presso EDQM.
Flarer SA ha annullato il rischio di rottura di stock delle formulazioni finite dei produttori, evitando di incorrere nel decadimento delle autorizzazioni all’immissione in commercio dei farmaci, sia di proprietà dei propri clienti che di tutti i titolari AIC europei.
Flarer SA ha così garantito la fornitura dell’API – Procaina HCl, con un alto livello qualitativo, su tutto il mercato europeo e, potenzialmente, su quello mondiale.